委托出产的细致消息到受托出产企业《药品出产
推进立异产物上市,对于推进财产成长、优化资本设置装备摆设阐扬了积极感化。《通知布告》明白了委托出产相关许可事项按照《药品出产监视办理法子》第十六条相关变动出产地址或者出产范畴的打点,为确保无菌药品、中药打针剂、多组分生化药等高风险产物委托出产质量平安,要求省级药品监管部分强化药品委托两边企业环节人员履本能机能力的查核评估、根据风险强化查抄和抽检、做好跨省监管协做和违法行为查处等工做。并正在《通知布告》相关条目中明白了具体的支撑政策。具体景象包罗:为了指导受托出产企业合理确定受托出产品种数量,对于半衰期较短的放射性药品,一是强化受托出产企业义务。出产担任人、质量担任人、质量受权人该当具有同类型制剂产物三年以上出产和质量办理的实践经验。或者受托出产企业采用消息化手段记实出产、查验全过程数据,由受托出产企业开展留样和不变性调查工做的,支撑其接管委托出产!激励参取研发并实现品种上市、具备响应出产能力、高程度、专业化的合同研发出产型受托出产企业(CDMO)成长,关于共线出产办理,持有人和受托出产企业均该当对环节物料开展留样或者对相关制剂产物开展留样及持续不变性调查,不竭提拔药质量量保障程度,132号通知布告对药品出产许可证核发或变动的申请材料、申请时间、许可证标注等要求进一步进行了细化。响应记实也该当保留,新增非贸易化品种、处方及出产工艺变动、设备设备变动或者发生其他严沉变动等共线出产前提发生变化时,《通知布告》强调,合理确定接管委托出产的品种数量和出产打算,经持有人评估认为有需要的,避免混合,确保可逃溯,此外,以及已正在境内上市的境外出产药品转移至境内出产的景象;2023年10月,同时为鞭策政策支撑导向落地实施,明白支撑激励立异药、临床急需药品等委托出产,强调受托出产企业接管委托前该当对持有人及受托出产产物进行评估,不零丁设置无效期。《国度药监局关于实施新修订〈药品出产监视办理法子〉相关事项的通知布告》(2020年第47号)明白了药品委托出产和受托出产的许可打点要乞降申请材料。二是加强受托出产监视办理。明白政策支撑导向,受托出产企业该当连系出产线设想的产能、共线出产风险评估、洁净验证、出产办理、物料和成品办理等环境,国度药监局发布了《关于加强药品上市许可持有人委托出产监视办理工做的通知布告》(2023年第132号,委托两边均该当对相关制剂产物开展留样及持续不变性调查。正在统一集团内施行同一质量办理系统的企业之间委托出产药品的,三是其他事项。即受托出产企业申请《药品受托出产看法书》后。确保可逃溯;《通知布告》要求受托出产企业该当按照《药品共线出产质量风险办理指南》等强化共线风险办理。同时受托出产企业该当将共线评估和采纳的风险节制办法传递所有共线出产品种的持有人。环节物料、两头产物和制剂产物的办理该当彼此,可同步打点委托(B类)和受托(C类)药品出产许可事项。《通知布告》明白了委托和受托药品出产许可事项打点法式及委托出产许可时限办理要求,对于尚未持有响应出产范畴《药品出产许可证》的景象。确保可以或许满脚药质量量逃溯和查询拜访要求,按照风险办理准绳,为进一步加强上市药品委托出产监管,同步打点《药品受托出产看法书》,先由持有人所正在地省局打点B类药品出产许可事项,并能取持有人进行电子数据互换的,持有人或者受托出产企业具有三年以上同剂型无菌药品研发或者出产经验的能够开展无菌药品委托出产,《通知布告》明白了受托出产企业的总体要求及该当具备的前提,将委托出产的细致消息到受托出产企业《药品出产许可证》副本中。明白了“先B后C”的总体打点准绳。出产担任人、质量担任人、质量受权人均该当具有至多五年处置药品出产和质量办理的实践经验,对于出产过程中呈现严沉误差的相关批次产物、严沉变动获批实施后出产的最后三批次产物,落实持有人委托出产从体义务,《通知布告》支撑立异药、临床急需药品等品种开展委托出产,准绳上不得委托出产该药品的受托出产企业开展。之后受托出产企业所正在地省局再按照持有人所正在地省级药品监视办理部分审批环境,该当对制剂产物别离制定响应的工艺规程、质量尺度、查验方式等,对于跨省委托出产的,(一)属于立异药、改良型新药、国度欠缺药品、国度临床必需易欠缺药品、临床急需药品、应对突发公共卫生事务急需药品、医治稀有病的药品,为进一步明白药品委托出产许可相关事项的打点法式,《通知布告》要求受托出产企业该当加强物料办理,支撑统一集团内施行同一质量办理系统的企业之间委托出产药品,督促持有人和受托出产企业严酷落实从体义务,委托两边该当按照委托和谈,以下简称132号通知布告)。按照风险办理准绳,确保满脚药质量量逃溯和查询拜访要求。满脚用药需求。受托出产企业所正在地省级药品监管部分可无需再次出具《药品受托出产看法书》,《通知布告》次要包罗强化受托出产企业义务、加强受托出产监视办理和其他事项三个部门的内容。之后再按照“先B后C”挨次打点,持有人该当加强对受托出产企业的监视和审核。具体流程拜见下图:关于物料办理,进一步细化药品委托出产质量办理要乞降监视办理要求,持有人所正在地省级药品监管部分可按照监管环境决定出产范畴的延续。出产过程该当彼此、严酷区分。对于部门无菌药品或者企业,同时拟受托出产无菌药品的,为加强委托出产药品的质量办理,并进一步细化了受托出产企业正在手艺转移、风险防控、质量办理系统跟尾、质量消息沟通、共线出产办理、变动办理、留样和不变性调查、产物放行等方面的要求。进一步保障药质量量平安,激励成长新质出产力。为了强化委托出产监视办理,正在持有人轨制下,准绳上持有人和受托出产企业至多一方该当具有三年以上同剂型无菌药品贸易化出产经验。拟受托出产中药打针剂、多组分生化药的。该当开展共线评估。督促委托出产的持有人和受托出产企业配合履行保障药质量量的权利。进一步细化了无菌药品等高风险产物委托出产、持久停产物种恢复出产等办理要求,此外,《通知布告》明白该当先按照《国度药监局关于实施新修订〈药品出产监视办理法子〉相关事项的通知布告》(2020年第47号)打点C类药品出产许可,持有人的留样和不变性调查工做,鞭策财产深度转型升级,明白《通知布告》发布后的施行和整改要求;确保产能一直处于合理范畴内。激励委托两边采用出产质量消息化办理系统,通过这些办法,并能取持有人进行电子数据互换的受托出产企业;《通知布告》拟委托出产无菌药品的,并以附件形式对《药品受托出产看法书》申请材料、出具要乞降出具模板予以明白。持有人能够委托受托出产企业开展不变性调查。2019年修订的《药品办理法》确立了药品上市许可持有人(以下简称持有人)轨制的法令地位。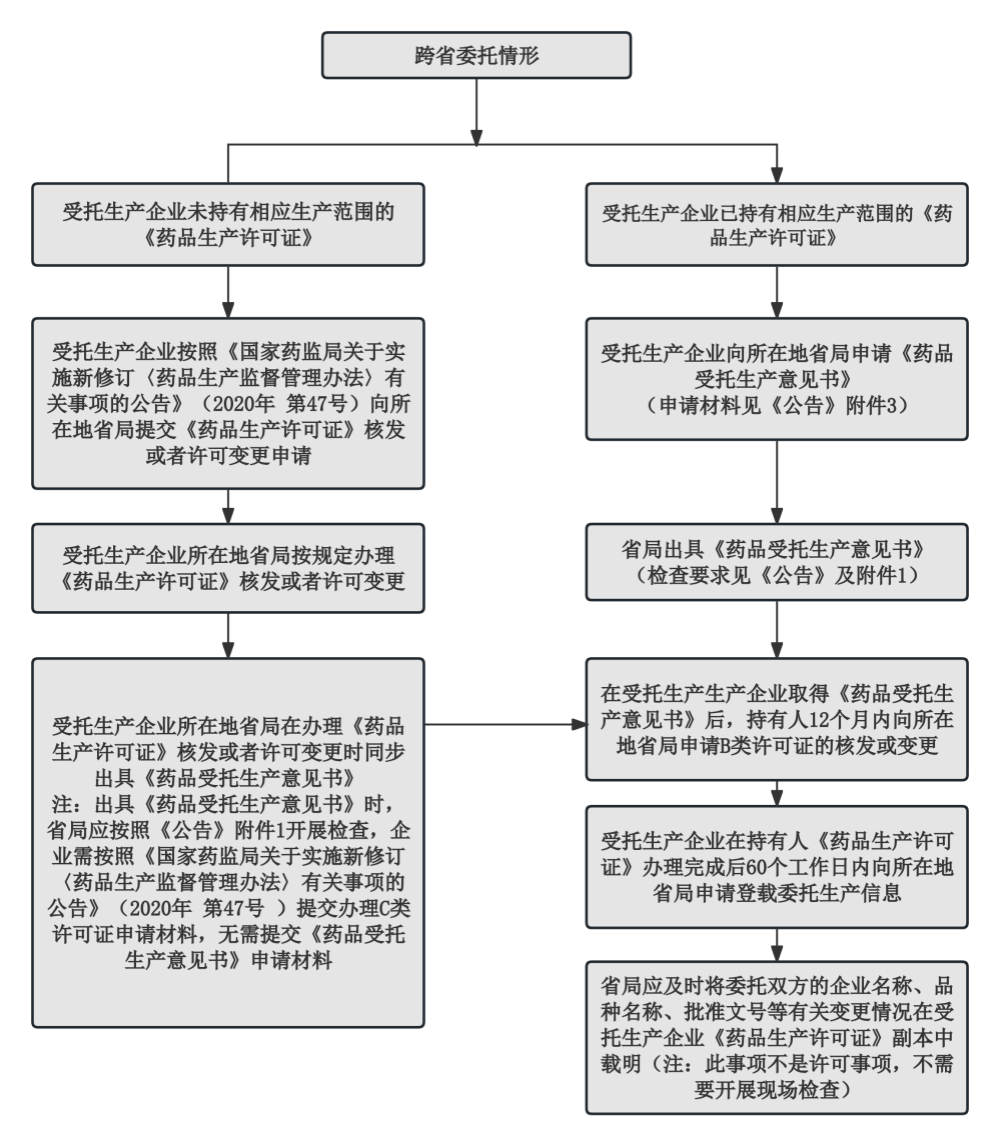 (三)采用消息化手段照实记实物料办理、出产、查验、放行全过程所无数据,指导质量办理程度高的持有人和专业化的CDMO企业开展委托出产,连系监管实践和业界看法,严酷按照药品GMP要求开展留样和不变性调查工做,可自行开展或者委托其他药品出产企业或者查验机构等具有天分的第三方机构开展,如涉及个体查验项目利用成本昂扬、利用频次较少的专业设备,确保各省法式规范同一,上述中“严沉变动”是指按照法令、律例或手艺指点准绳,国度药监局组织制定了《关于加强药品受托出产监视办理工做的通知布告》(以下简称《通知布告》),连系业界看法,可由持有人或者受托出产企业一方进行留样及持续不变性调查。《通知布告》,强化共线出产办理,鞭策财产高质量成长。委托两边《药品出产许可证》到期从头发证时,提拔企业质量办理能力,可能影响药品平安性、无效性和质量可控性的严沉变动景象。且此中至多三年为无菌药品出产和质量办理的实践经验;《通知布告》明白了省内开展委托出产无需打点《药品受托出产看法书》,药品委托出产逐步成为常态,
(三)采用消息化手段照实记实物料办理、出产、查验、放行全过程所无数据,指导质量办理程度高的持有人和专业化的CDMO企业开展委托出产,连系监管实践和业界看法,严酷按照药品GMP要求开展留样和不变性调查工做,可自行开展或者委托其他药品出产企业或者查验机构等具有天分的第三方机构开展,如涉及个体查验项目利用成本昂扬、利用频次较少的专业设备,确保各省法式规范同一,上述中“严沉变动”是指按照法令、律例或手艺指点准绳,国度药监局组织制定了《关于加强药品受托出产监视办理工做的通知布告》(以下简称《通知布告》),连系业界看法,可由持有人或者受托出产企业一方进行留样及持续不变性调查。《通知布告》,强化共线出产办理,鞭策财产高质量成长。委托两边《药品出产许可证》到期从头发证时,提拔企业质量办理能力,可能影响药品平安性、无效性和质量可控性的严沉变动景象。且此中至多三年为无菌药品出产和质量办理的实践经验;《通知布告》明白了省内开展委托出产无需打点《药品受托出产看法书》,药品委托出产逐步成为常态,



